
فاطمه فراهانی کنگرانی
دانش آموخته زیست شناسی دانشگاه اراک
ژنومیکس
سه تحول اساسی مانند تعیین توالی ژنوم مانند پروژه ژنوم انسان و ایجاد دانش OMICS و تئوری های مبتنی بر کامپیوتر و مدل سازی زیستی باعث پیشرفت عظیم زیست شناسی شد.
دانش های OMICS شامل ژنومیکس،پروتئومیکس،متابولومیکس و … می شود،که هرکدام دارای زیرشاخه های دیگری هم هستند.
در این مقاله به شرح دانش ژنومیکس و تاریخچه آن و بیوانفورماتیک که با ژنومیکس به همکاری هم می پردازند، پرداخته می شود.
تاریخچه مختصر ژنومیک
DNA برای اولین بار در اوایل سال 1869 با پیشرفت های فناوری در دهه 1950 مانند ایجاد ایزوتوپ ها و مولکول های زیستی رادیواکتیو جدا شد. همچنین در این مدت ، توصیف ساختار مارپیچ DNA توسط دانشمندان جیمز دی واتسون و فرانسیس H.C کریک در سال 1953 انجام شد.
اما تاریخ ژنومیکس مدرن واقعاً از دهه 1970 آغاز می شود که اولین ژنوم توسط بیوشیمیست فردریک سنگر توالی یابی شد.او ژنوم های یک ویروس و میتوکندری را در اوایل دهه 1970 تعیین توالی کرد. سنگر و تیم او همچنین تکنیک هایی برای تعیین توالی ، ذخیره سازی داده ها،نقشه برداری از ژنوم و موارد دیگر ایجاد کردند.
دانشمند دیگری که نقش مهمی در ژنومیکس مدرن داشت والتر فایر است. در سال 1972،او و تیم تحقیقاتی او از آزمایشگاه زیست شناسی مولکولی دانشگاه گنت در بلژیک اولین کسی بودند که یک ژن را توالی دادند.
در سال 1990،پروژه ژنوم انسانی، یک تحقیقات بین المللی ژنومیکس با بودجه عمومی برای تعیین توالی ژنوم انسان و همچنین شناسایی ژنهای موجود در آن،توسط انستیتوهای بهداشت ملی و وزارت انرژی ایالات متحده آغاز شد. هدف این گروه توالی یابی و شناسایی سه میلیارد واحد شیمیایی در ژنوم انسان بود.هدف از این کار یافتن ریشه های ژنتیکی بیماری و کمک به توسعه درمان ها بود.
هدف از پروژه ژنوم انسانی این بود که طی 24 ساعت از زمان مونتاژ ، کلیه اطلاعات توالی ژنوم انسانی را آزادانه در دسترس عموم قرار دهد.این پروژه به مدت 13 سال فعال بود.
ژنوم ها با گذشت زمان تکامل می یابند،از نظر ترتیب یا اندازه تغییر می کنند.مطالعه تکامل ژنوم شامل زمینه های مختلفی است و به طور مداوم در حال تغییر است زیرا ژنوم های بیشتری توالی می یابند و در دسترس جامعه علمی و عموم مردم قرار می گیرند.
ژنومیکس
ژنومیکس یک علم بین رشته ای از زیست شناسی است که بر ساختار ، عملکرد ، تکامل ، نقشه برداری و ویرایش ژنوم ها تمرکز دارد.
ژنوم مجموعه کاملی از DNA ارگانیسم است که شامل همه ژن های آن است. برعکس ژنتیک ، که به مطالعه ژن های فردی و نقش آنها در وراثت اشاره دارد ، هدف ژنومیکس خصوصیات و کمی سازی جامع همه ژن های ارگانیسم ، روابط متقابل و تأثیر آنها بر ارگانیسم است. ژن ها ممکن است تولید پروتئین ها را با کمک آنزیم ها و مولکول های پیام رسان هدایت کنند. به نوبه خود ، پروتئین ها ساختارهای بدن مانند اندام ها و بافت ها را تشکیل می دهند و همچنین واکنش های شیمیایی را کنترل می کنند و سیگنال ها را بین سلول ها حمل می کنند.
ژنومیکس همچنین شامل توالی و تجزیه و تحلیل ژنوم ها از طریق استفاده از توالی DNA با توان بالا و بیوانفورماتیک برای جمع آوری و تجزیه و تحلیل عملکرد و ساختار کل ژنوم ها است.
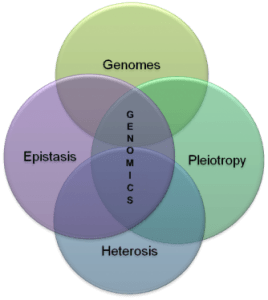
پیشرفت در ژنومیکس انقلابی در تحقیقات مبتنی بر کشف و سیستم بیولوژی برای تسهیل درک حتی پیچیده ترین سیستم های زیستی مانند مغز ایجاد کرده است. این زمینه همچنین شامل مطالعات پدیده های درون ژنومیک (درون ژنوم)، پدیده هایی مانند اپیستاز (اثر یک ژن بر ژن دیگر) ،پلیوتروپی (یک ژن که بیش از یک ویژگی را تحت تأثیر قرار می دهد) ،هتروزیس(توان هیبریدی) و دیگر فعل و انفعالات بین جایگاه و آلل در ژنوم.










دیدگاه خود را ثبت کنید
تمایل دارید در گفتگوها شرکت کنید؟در گفتگو ها شرکت کنید.